Princip rada baterije
Kako funkcionira zidni sat, daljinski upravljač za televizor ili radio-upravljana dječja igračka? Većina će ljudi bez oklijevanja odgovoriti “iz baterija” i u principu će biti u pravu. No, malo je vjerojatno da će itko od njih znati reći kako se točno prenosiva baterija utrostručuje, kako funkcionira i bez čega bi cijeli proces prijenosa električne struje od baterije do krajnjeg potrošača bio nemoguć. Popunimo ovu dosadnu prazninu u znanju.
Princip rada baterije
Da biste razumjeli princip rada konvencionalne AA baterije, morate imati opće razumijevanje njezine strukture. Dakle, svaka baterija sastoji se od tri glavna elementa - anode, katode i elektrolita. Štoviše, potonji mogu imati gotovo bilo koje agregatno stanje: katoda i anoda smještene u fiziološku otopinu u načelu su također "baterija", samo u obliku koji je neuobičajen za prosječnu osobu.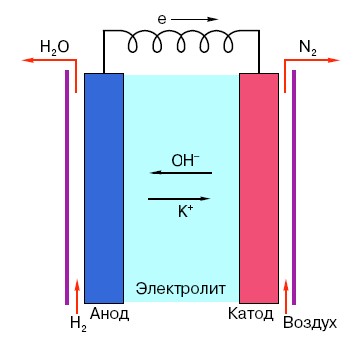
Zanimljiv! Takozvani “naponski stup”, koji je izumio Alessandro Volta, također je imao sve elemente potrebne za proizvodnju električne struje. Sastojao se od ploča od cinka i bakra naslaganih jedna na drugu, između kojih je kao “sloj” stavljena tkanina natopljena kiselinom.
Anoda u takvim sustavima je glavni izvor elektrona, koji, kao što znamo iz školskog tečaja fizike, imaju negativan naboj.Negativno nabijene čestice privlače pozitivne, au ovom slučaju površina katode djeluje kao "plus".
Ali to nije dovoljno za pojavu električne struje, jer elektroni također trebaju svojevrsnu "autocestu" - medij koji bi podržavao interakciju katode i anode. Ovdje se "na pozornici" pojavljuje elektrolit - sol, lužina ili kiselina koja može provoditi struju.
Pogledajmo princip rada na konkretnom primjeru: postoji baterija s naponom od 18 volti. Napon između elektroda u njemu je stabilan dok se ne spoji na mrežu. Čim se pojavi potrošač (npr. obična žarulja), napon počinje postupno padati, struja počinje teći s “negativne” elektrode na “pozitivnu”, a u elektrolitu dolazi do kemijske reakcije usmjerene na održavanje razlike potencijala između elektroda.
Referenca. Što je potrošaču potrebno više energije, to je intenzivnija reakcija unutar baterije i brže će otkazati.
Kako radi punjiva baterija, kako se razlikuje od obične
Dakle, pogledali smo klasične “prst” i “mali prst” baterije i znamo da je radni vijek većine njih strogo ograničen (ma što poznati proizvođači kažu). Ali što je s takozvanim baterijama - baterijama tipa baterija koje ne samo da mogu trošiti energiju tijekom procesa reakcije, već je i akumulirati i pohraniti dugo vremena?
Da bismo razumjeli princip rada baterije, potrebno je obratiti se na kemiju. Uzmimo kao primjer... Običnu vatru na drveni ugljen.Koliko god plamen izgledao lijepo i fascinantno, svaki kemičar koji ga promatra zna da je taj proces samo dugotrajna reakcija oksidacije goriva. Zapaljeni ugljen stupa u interakciju s kisikom i kao rezultat ove reakcije dobivamo:
- ugljični dioksid;
- svjetlo;
- toplo.
I ako su posljednje dvije točke sposobne zagrijati dušu i tijelo, onda ugljični dioksid ne možemo koristiti ni na koji način, jer je on nusprodukt reakcije, koji je, zapravo, njezin otpad. Reakcija oksidacije prestaje kada ponestane polaznih elemenata: kisika i ugljena. Zaustavljanje reakcije u bateriji događa se na potpuno isti način kada su polazne tvari potpuno iscrpljene i ostaje samo “otpad”.
U bateriji se sve događa malo drugačije. Činjenica je da reakcija koja se u njemu odvija pripada kategoriji reverzibilnih, odnosno pod određenim uvjetima može se "preokrenuti", vraćajući sve tvari u prvobitno stanje. Mogućnost reverzibilne reakcije koja se događa u bateriji omogućuje njezino punjenje.
U bateriji spojenoj na mrežu, reakcija se odvija u suprotnom smjeru, a struja teče od "plus" do "minus", a ne obrnuto. Kao rezultat, produkt reakcije tvori početne tvari, a vlasnik baterije dobiva dostupnu "oporavljenu" energiju u prijenosnom formatu. To je sve!





